Los electrones se comportan como ondas.
Los físicos saben desde hace mucho tiempo que la luz es una onda electromagnética. Hasta el día de hoy, nadie duda de esta posición, ya que la luz muestra claramente todos los signos del comportamiento de las ondas: las ondas de luz pueden superponerse entre sí, generando un patrón de interferencia, también pueden separarse, doblando obstáculos a lo largo del tiempo de difracción.
Cuando vemos un pájaro que camina como un pato, nada como un pato y grazna como un pato, llamamos a ese pájaro pato. Entonces la luz es onda electromagnéticabasado en signos observados objetivamente del comportamiento de tal onda en la luz.

Sin embargo, a finales del siglo XIX y XX, los físicos empezarían a hablar del «dualismo partícula-onda» de la luz. Resulta que el conocimiento de que la luz es una onda electromagnética no es todo lo que la ciencia sabe sobre la luz. Los científicos han descubierto una característica muy interesante en la luz.
Resulta que de alguna manera la luz se manifiesta COMO el comportamiento de una corriente de partículas de alguna manera.Se encontró que la energía transportada por la luz, después de ser contada durante un cierto período de tiempo por un detector especial, resulta estar compuesta de todos modos por piezas individuales (completas).
Por lo tanto, se hizo cierto que la energía de la luz es discreta, porque está compuesta, por así decirlo, de partículas individuales - "quanta", es decir, de las porciones enteras más pequeñas de energía. Tal partícula de luz, que transportaba una unidad (o cuanto) de energía, se denominó fotón.
La energía de un fotón se encuentra mediante la siguiente fórmula:
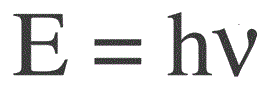
E — energía fotónica, h — constante de Planck, v — frecuencia.
El físico alemán Max Planck estableció por primera vez experimentalmente el hecho de la discreción de la onda de luz y calculó el valor de la constante h, que aparece en la fórmula para encontrar la energía de los fotones individuales. Este valor resultó ser: 6.626 * 10-34 J * s. Planck publicó los resultados de su trabajo a fines del siglo XX.

Considere, por ejemplo, un rayo púrpura. La frecuencia de dicha luz (f o v) es 7,5 * 1014 Hz. La constante de Planck (h) es 6,626 * 10-34 J * s. Esto significa que la energía del fotón, (E), característico del color violeta, es de 5 * 10-19 J. Esta es una porción de energía tan pequeña que es muy difícil de capturar.
Imagine un arroyo de montaña: fluye como una unidad y es imposible ver a simple vista que el arroyo en realidad está formado por moléculas de agua individuales. Hoy, sin embargo, sabemos que el objeto macroscópico, el flujo, es en realidad discreto, es decir, consta de moléculas individuales.
Esto significa que si podemos colocar un contador de moléculas junto a la corriente para contar las moléculas de agua que pasan a medida que fluye la corriente, el detector siempre solo contará números enteros de moléculas de agua, no números parciales.
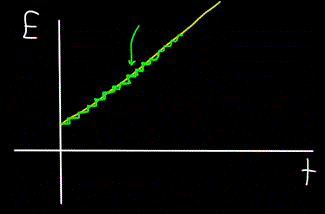
De manera similar, el gráfico de la energía total del fotón E, calculado en el tiempo t, siempre resultará no lineal (figura amarilla), sino paso a paso (figura verde):
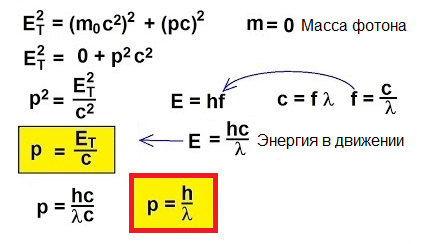
Entonces, los fotones se mueven, transportan energía, por lo tanto, tienen impulso. Pero un fotón no tiene masa. Entonces, ¿cómo puedes encontrar el impulso?
De hecho, para objetos que se mueven a velocidades cercanas a la velocidad de la luz, la fórmula clásica p = mv es simplemente inaplicable. Para entender cómo encontrar el impulso en este caso inusual, volvamos a la relatividad especial:
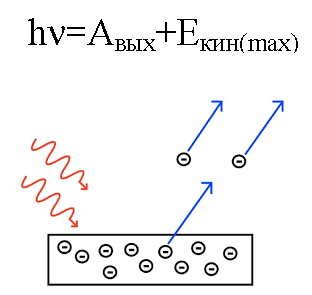
En 1905, Albert Einstein explicó desde este punto de vista efecto fotoeléctrico… Sabemos que la placa de metal tiene electrones en su interior, que en su interior son atraídos por los núcleos cargados positivamente de los átomos y, por lo tanto, quedan retenidos en el metal. Pero si haces brillar una placa de este tipo con luz de CIERTA frecuencia, puedes sacar electrones de la placa.
Es como si la luz se comportara como una corriente de partículas con momento y, aunque un fotón no tiene masa, de alguna manera interactúa con un electrón en un metal y, bajo ciertas condiciones, un fotón puede eliminar un electrón.
Entonces, si un fotón que incide en la placa tiene suficiente energía, entonces el electrón será expulsado del metal y saldrá de la placa con una velocidad v. Tal electrón eliminado se llama fotoelectrón.
Dado que el electrón eliminado tiene una masa conocida m, tendrá una cierta energía cinética mv.
La energía del fotón, cuando actuó sobre el metal, se convierte en la energía de la salida del electrón del metal (función de trabajo) y en la energía cinética del electrón, por lo que el electrón eliminado comienza a moverse. del metal, dejándolo.
Supongamos que un fotón de longitud de onda conocida golpea la superficie de un metal para el cual se conoce la función de trabajo (de un electrón del metal). En este caso, la energía cinética de un electrón emitido por un metal dado se puede encontrar fácilmente, así como su velocidad.
Si la energía del fotón no es suficiente para que el electrón realice la función de trabajo, entonces el electrón simplemente no puede abandonar la superficie del metal dado y el fotoelectrón no se forma.
En 1924, un físico francés Luis de Broglie presentó una idea innovadora según la cual no solo los fotones de luz, sino también los propios electrones pueden comportarse como ondas. El científico incluso derivó una fórmula para la longitud de onda hipotética del electrón. Estas ondas se denominaron posteriormente "ondas de Broglie".
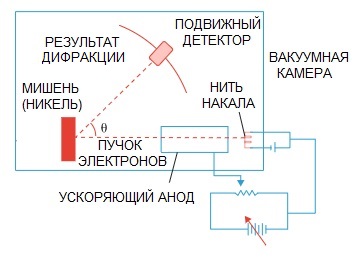
La hipótesis de De Broglie se confirmó más tarde. Un experimento de física sobre la difracción de electrones, realizado en 1927 por los científicos estadounidenses Clinton Davison y Lester Germer, finalmente señaló la naturaleza ondulatoria del electrón.
Cuando un haz de electrones se dirigió a través de una estructura atómica especial, parece que el detector debería haber registrado la imagen como partículas volando una tras otra, lo que lógicamente se esperaría si los electrones fueran partículas.
Pero en la práctica tenemos una imagen característica de la difracción de ondas. Además, las longitudes de estas ondas son completamente consistentes con el concepto propuesto por de Broglie.
En última instancia, la idea de de Broglie hizo posible explicar el principio del modelo atómico de Bohr, y más tarde hizo posible que Erwin Schrödinger generalizara estas ideas y sentara las bases de la física cuántica moderna.
