Cómo funcionan y funcionan las baterías.
 En el sentido más amplio de la palabra en tecnología, el término “batería” se refiere a un dispositivo que permite bajo ciertas condiciones de funcionamiento acumular cierto tipo de energía, y en otras utilizarla para las necesidades humanas.
En el sentido más amplio de la palabra en tecnología, el término “batería” se refiere a un dispositivo que permite bajo ciertas condiciones de funcionamiento acumular cierto tipo de energía, y en otras utilizarla para las necesidades humanas.
Se utilizan donde es necesario recolectar energía durante un tiempo determinado y luego utilizarla para llevar a cabo grandes procesos intensivos en mano de obra. Por ejemplo, los acumuladores hidráulicos utilizados en las esclusas permiten que los barcos se eleven a un nuevo nivel en el lecho del río.
Las baterías eléctricas funcionan con electricidad según el mismo principio: primero, acumulan (acumulan) electricidad de una fuente de carga externa y luego se la dan a los consumidores conectados para que trabajen. Por su naturaleza, pertenecen a las fuentes de corriente química capaces de realizar ciclos periódicos de descarga y carga repetidamente.
Durante el funcionamiento, se producen constantemente reacciones químicas entre los componentes de las placas de electrodos con su sustancia de relleno, el electrolito.
Un diagrama esquemático de un dispositivo de batería se puede representar mediante un dibujo simplificado cuando se insertan dos placas de diferentes metales con cables en el cuerpo del recipiente para proporcionar contactos eléctricos. Se vierte un electrolito entre las placas.
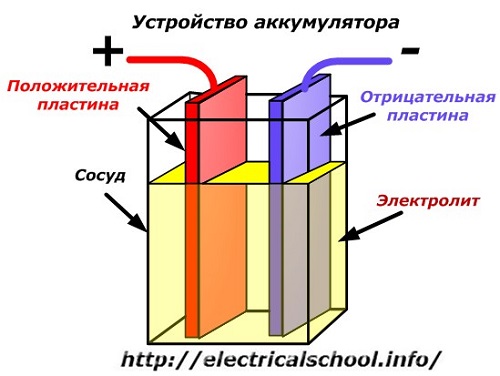
Funcionamiento de la batería cuando está descargada
Cuando una carga, como una bombilla, se conecta a los electrodos, se crea un circuito eléctrico cerrado a través del cual fluye la corriente de descarga. Se forma por el movimiento de electrones en piezas metálicas y aniones con cationes en el electrolito.
Este proceso se muestra convencionalmente en un diagrama con un diseño de electrodo de níquel-cadmio.
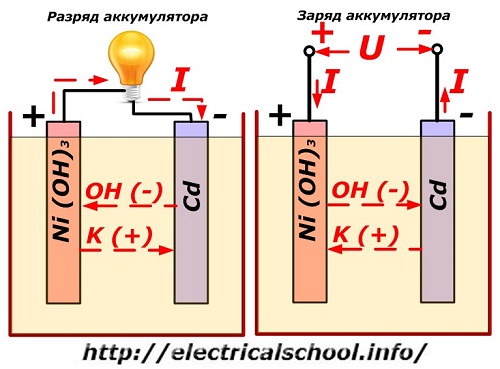
Aquí, los óxidos de níquel con aditivos de grafito, que aumentan la conductividad eléctrica, se utilizan como material del electrodo positivo. El metal del electrodo negativo es cadmio esponjoso.
Durante la descarga, las partículas de oxígeno activo de los óxidos de níquel se liberan en el electrolito y se dirigen a las placas negativas, donde se oxida el cadmio.
Rendimiento de la batería al cargar
Cuando la carga está apagada, se aplica un voltaje constante (en ciertas situaciones, pulsante) a los terminales de la placa de un valor mayor que el de una batería cargada de la misma polaridad, cuando los terminales positivo y negativo de la fuente y el consumidor coinciden. .
El cargador siempre tiene más potencia, lo que "suprime" la energía residual de la batería y crea una corriente eléctrica en sentido contrario a la descarga. Como resultado, los procesos químicos internos entre los electrodos y el electrolito cambian. Por ejemplo, en una caja de placas de níquel-cadmio, el electrodo positivo se enriquece con oxígeno y el negativo, a un estado de cadmio puro.
Cuando la batería se descarga y se carga, la composición química del material de las placas (electrodos) cambia, pero el electrolito no cambia.
Métodos de conexión de la batería
Coneccion paralela
La cantidad de corriente de descarga que una persona puede soportar depende de muchos factores, pero principalmente del diseño, los materiales utilizados y sus dimensiones. Cuanto mayor sea el área de las placas en los electrodos, mayor será la corriente que pueden soportar.
Este principio se usa para conectar celdas del mismo tipo en paralelo en baterías cuando es necesario aumentar la corriente a la carga, pero para cargar tal diseño, será necesario aumentar la potencia de la fuente. Este método rara vez se usa para estructuras prefabricadas, ya que ahora es mucho más fácil comprar inmediatamente la batería necesaria. Pero los fabricantes de baterías de ácido lo usan, conectando diferentes placas en bloques individuales.
Conexión en serie
Dependiendo de los materiales utilizados, se puede generar un voltaje de 1,2/1,5 o 2,0 voltios entre las dos placas de electrodos de las baterías habituales en la vida cotidiana. (En realidad, este rango es mucho más amplio). Obviamente, no es suficiente para muchos dispositivos eléctricos. Por lo tanto, las baterías del mismo tipo se conectan en serie, y esto a menudo se hace en un solo caso.
Un ejemplo de tal diseño es el desarrollo automotriz generalizado basado en placas de electrodos de plomo y ácido sulfúrico.
Por lo general, entre las personas, especialmente entre los conductores de transporte, es costumbre llamar batería a cualquier dispositivo, independientemente del número de sus elementos constituyentes: cajas. Sin embargo, esto no es del todo correcto.La estructura, ensamblada a partir de varias cajas conectadas en serie, ya es una batería, a la que se le asigna el nombre abreviado «АКБ»... Su estructura interna se muestra en la figura.
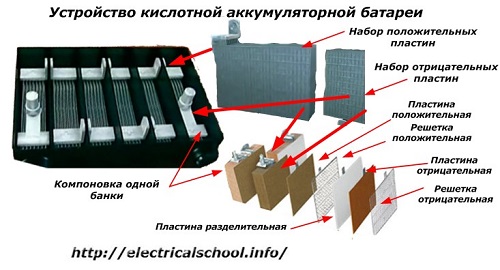
Cada uno de los frascos consta de dos bloques con un juego de placas para los electrodos positivo y negativo. Los bloques encajan entre sí sin contacto metálico con la posibilidad de una conexión galvánica fiable a través del electrolito.
En este caso, las placas de contacto tienen una rejilla adicional y están separadas entre sí por una placa separadora.
Conectar las placas en bloques aumenta su área de trabajo, reduce la resistencia total de toda la estructura y le permite aumentar la potencia de la carga conectada.
En el exterior de la caja, dicha batería tiene los elementos que se muestran en la siguiente figura.
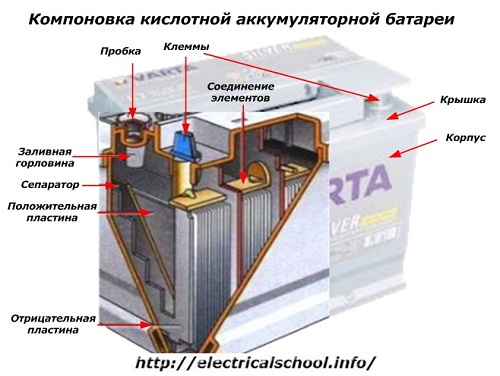
Muestra que la carcasa de plástico resistente está sellada con una cubierta y equipada con dos terminales (generalmente en forma de cono) en la parte superior para la conexión al circuito eléctrico del automóvil. Las marcas de polaridad están estampadas en sus terminales: «+» y «-«. Por lo general, el terminal positivo tiene un diámetro ligeramente mayor que el terminal negativo para bloquear errores de cableado.
Las baterías reparables tienen un orificio de llenado en la parte superior de cada vaso para controlar el nivel de electrolito o agregar agua destilada durante el funcionamiento. Se enrosca un tapón que protege las cavidades internas de la carcasa de la contaminación y al mismo tiempo evita que se derrame el electrolito cuando se inclina la batería.
Dado que con una carga potente es posible la gasificación del electrolito (y este proceso es posible durante la conducción intensiva), se hacen agujeros en los tapones para evitar que aumente la presión dentro de la caja.El oxígeno y el hidrógeno, así como los vapores de electrolitos, salen a través de ellos. Se recomienda evitar tales situaciones que impliquen corrientes de carga excesivas.
La misma figura muestra la conexión de los elementos entre los bancos y la disposición de las placas de electrodos.
Las baterías de arranque de automóviles (plomo ácido) funcionan según el principio de doble sulfatación. Durante la descarga/carga se produce sobre ellos un proceso electroquímico, acompañado de un cambio en la composición química de la masa activa de los electrodos con liberación/absorción de agua en el electrolito (ácido sulfúrico).
Esto explica el aumento de la gravedad específica del electrolito durante la carga y la disminución cuando la batería está descargada. En otras palabras, el valor de la densidad le permite evaluar el estado eléctrico de la batería. Se usa un dispositivo especial para medirlo: un hidrómetro de automóvil.
El agua destilada, que forma parte del electrolito de las baterías ácidas, se convierte en estado sólido: hielo a temperaturas negativas.Por lo tanto, para evitar que las baterías de los automóviles se congelen en climas fríos, es necesario aplicar medidas especiales previstas en las reglas. para la explotación.
¿Qué tipos de baterías hay?
La producción moderna para diversos fines produce más de tres docenas de productos con diferente composición de electrodos y electrolitos. 12 modelos conocidos funcionan solo con litio.

Como metal de electrodo se pueden encontrar los siguientes:
-
dirigir;
-
hierro;
-
litio;
-
titanio;
-
cobalto;
-
cadmio;
-
níquel;
-
zinc;
-
plata;
-
vanadio;
-
aluminio
-
algunos otros artículos.
Afectan las características de salida eléctrica y por lo tanto la aplicación.
La capacidad de soportar cargas elevadas a corto plazo resultantes de la rotación de los cigüeñales de los motores de combustión interna por motores de arranque eléctricos es característica de las baterías de plomo-ácido. Son ampliamente utilizados en transporte, fuentes de alimentación ininterrumpida y sistemas de energía de emergencia.
Estándar celdas galvánicas (baterías normales) generalmente se reemplazan por baterías de níquel-cadmio, níquel-zinc e hidruro de níquel-metal.
Pero los diseños de iones de litio o polímeros de litio funcionan de manera confiable en dispositivos móviles e informáticos, herramientas de construcción e incluso vehículos eléctricos.
Según el tipo de electrolito utilizado, las baterías son:
-
agrio
-
alcalino.
Existe una clasificación de las pilas según su finalidad. Por ejemplo, en las condiciones modernas, han aparecido dispositivos que se utilizan para la transferencia de energía, recargando otras fuentes. La llamada batería externa ayuda a los propietarios de muchos dispositivos móviles en ausencia de una red eléctrica alterna. Es capaz de cargar repetidamente una tableta, teléfono inteligente, teléfono móvil.
Todas estas baterías tienen el mismo principio de funcionamiento y un dispositivo similar. Por ejemplo, el modelo de dedo de iones de litio que se muestra en la siguiente figura repite de muchas maneras el diseño de las baterías de ácido discutidas anteriormente.
Aquí vemos los mismos electrodos de contacto, placas, separador y carcasa. Solo se fabrican teniendo en cuenta otras condiciones de trabajo.
Características eléctricas básicas de una batería.
El funcionamiento del dispositivo se ve afectado por los parámetros:
-
capacidad;
-
Densidad de energia;
-
autodescarga;
-
régimen de temperatura.
La capacidad se llama la carga máxima de la batería, que puede dar durante la descarga al voltaje más bajo. Se expresa en colgantes (sistema SI) y amperios-hora (unidad fuera del sistema).
Como tipo de capacidad existe la «capacidad energética», que determina la energía liberada durante la descarga a la tensión mínima admisible. Se mide en julios (SI) y vatios-hora (unidades no pertenecientes al SI).
Densidad de energía expresada como la relación entre la cantidad de energía y el peso o volumen de la batería.
La autodescarga considera la pérdida de capacidad después de la carga en ausencia de carga en los terminales. Esto depende del diseño y se ve agravado por las fallas en el aislamiento entre los electrodos por muchas razones.
La temperatura de funcionamiento afecta las propiedades eléctricas y, en caso de desviaciones graves de la norma especificada por el fabricante, puede dañar la batería. El calor y el frío son inaceptables, afectan el curso de las reacciones químicas y la presión del ambiente dentro de la caja.
