¿Cuál es la diferencia entre el grafeno y el grafito?
Un elemento químico notable, el carbono es uno que se encuentra convenientemente en el número 6 en el decimocuarto grupo del segundo período de la tabla periódica de elementos químicos. Desde la antigüedad se conocen el diamante y el grafito, dos de las más de nueve modificaciones alotrópicas de este elemento descubiertas hasta el momento. Por cierto, es el carbono el que tiene el mayor número, en comparación con otras sustancias, de modificaciones alotrópicas conocidas por la ciencia moderna.
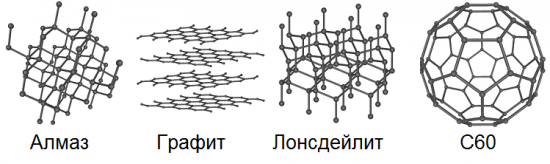
La alotropía implica la posibilidad de la existencia en la naturaleza de un mismo elemento químico en forma de dos o más sustancias simples, las denominadas formas alotrópicas o modificaciones alotrópicas, que provocan diferencias en estas sustancias tanto en estructura como en propiedades. Entonces, el carbono tiene 8 de estas formas básicas: diamante, grafito, lonsdaleita, fullerenos (C60, C540 y C70), carbono amorfo y nanotubos de pared simple.
Entre estas formas de carbono hay propiedades y caracteres completamente diferentes: sustancias blandas y duras, transparentes y opacas, baratas y caras. Sin embargo, comparemos dos modificaciones de carbono similares: grafito y grafeno.

Todos estamos familiarizados con el graffiti desde la escuela.La mina de un lápiz ordinario es exactamente grafito. Es bastante suave, resbaladizo y grasoso al tacto, los cristales son placas, las capas de átomos están ubicadas una encima de la otra, por lo tanto, al frotar, por ejemplo, en papel, las escamas individuales de la estructura cristalina en capas de grafito se desprenden fácilmente. , dejando un característico rastro oscuro en el papel.
El grafito conduce bien la corriente eléctrica, su resistencia es en promedio de 11 Ohm*mm2/m, pero la conductividad del grafito no es la misma debido a la anisotropía natural de sus cristales. Así, la conductividad a lo largo de los planos del cristal es cientos de veces mayor que la conductividad en estos planos. La densidad del grafito es de 2,08 a 2,23 g/cm3.
En la naturaleza, el grafito se forma a altas temperaturas en rocas ígneas y volcánicas, en skarns y pegmatitas. Ocurre en vetas de cuarzo con minerales en depósitos polimetálicos hidrotermales de temperatura intermedia. Está ampliamente distribuida en rocas metamórficas.
Así, desde 1907, en la isla de Madagascar se han desarrollado las reservas más grandes del mundo de grafito natural en escamas. La isla consiste en rocas metamórficas precámbricas que emergen a la superficie en un terreno montañoso con marcas hipsométricas de 4,000-4,600 pies. El grafito se encuentra aquí en un cinturón de 400 millas de largo y domina las montañas en la parte este del centro de la isla.
El grafeno, a diferencia del grafito, no tiene una estructura cristalina a granel; presenta una red cristalina hexagonal bidimensional, de solo un átomo de espesor. En una modificación alotrópica de este tipo, el carbono no se produce de forma natural en absoluto, pero teóricamente se puede obtener de forma artificial. Podemos decir que un plano separado deliberadamente de la estructura cristalina a granel de múltiples capas del grafito será este mismo grafeno.
Inicialmente, los científicos no pudieron obtener grafeno en forma de una simple película bidimensional, debido a la inestabilidad de la materia en esta forma. Sin embargo, sobre un sustrato de óxido de silicio (debido a la unión con la capa dieléctrica) todavía era posible obtener grafeno de un átomo de espesor: en 2004, los científicos rusos Andrey Geim y Konstantin Novoselov de la Universidad de Manchester publicaron un informe en Science. en la obtención de grafeno de esta manera.
E incluso hoy en día, se justifican métodos tan simples de obtener grafeno para la investigación, como la exfoliación mecánica de una monocapa de carbono a partir de un cristal de grafito a granel utilizando cinta adhesiva (y métodos similares).
Los investigadores creen que gracias a su progreso, pronto surgirá una nueva clase de nanoelectrónica basada en grafeno, donde los transistores de efecto de campo tendrán menos de 10 nm de espesor. El caso es que la movilidad de los electrones en el grafeno es tan alta (10.000 cm2/V*s) que parece ser la alternativa más prometedora al silicio convencional en la actualidad.
La alta movilidad de los portadores es la capacidad de los electrones y los huecos para responder extremadamente rápido al efecto de los campos eléctricos aplicados, y esto es extremadamente importante para los transistores de efecto de campo, la unidad operativa básica de la electrónica moderna.
También hay perspectivas para la creación de varios sensores biológicos y químicos, así como películas delgadas para dispositivos fotovoltaicos y pantallas táctiles. A pesar de todo esto, la conductividad térmica del grafeno es 10 veces superior a la del cobre, y este criterio siempre es muy importante para la electrónica.