Resistencia a la corrosión de los metales.
¿Qué es la resistencia a la corrosión?
La capacidad de un metal para resistir la corrosión se denomina resistencia a la corrosión. Esta capacidad está determinada por la tasa de corrosión bajo ciertas condiciones. Se utilizan características cuantitativas y cualitativas para evaluar el grado de corrosión.

Las características cualitativas son:
-
cambiar la apariencia de la superficie metálica;
-
cambio en la microestructura del metal.
Las características cuantitativas son:
-
tiempo antes de la aparición del primer foco de corrosión;
-
el número de focos de corrosión formados durante un cierto período de tiempo;
-
adelgazamiento de metales por unidad de tiempo;
-
cambio en la masa de metal por unidad de área por unidad de tiempo;
-
el volumen de gas absorbido o liberado durante la corrosión por unidad de superficie por unidad de tiempo;
-
densidad de corriente eléctrica para una tasa de corrosión dada;
-
cambio en la propiedad durante un período de tiempo (propiedades mecánicas, reflectividad, resistencia eléctrica).
Diferentes metales tienen diferente resistencia a la corrosión.Para aumentar la resistencia a la corrosión se utilizan métodos especiales: aleación para acero, cromado, aluminizado, niquelado, pintado, zincado, pasivado, etc.
Hierro y acero

En presencia de oxígeno y agua pura, el hierro se corroe rápidamente, la reacción procede según la fórmula:
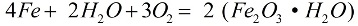
En el proceso de corrosión, una capa suelta de óxido cubre el metal, y esta capa no lo protege en absoluto de una mayor destrucción, la corrosión continúa hasta que el metal se destruye por completo. La corrosión más activa del hierro es causada por soluciones salinas: si hay presente en el aire incluso un poco de cloruro de amonio (NH4Cl), el proceso de corrosión será mucho más rápido. En una solución débil de ácido clorhídrico (HCl), la reacción también procederá activamente.
El ácido nítrico (HNO3) en una concentración superior al 50 % conducirá a la pasivación del metal; se cubrirá con una capa protectora, aunque frágil. El ácido nítrico vaporizado es seguro para el hierro.
El ácido sulfúrico (H2SO4) en una concentración superior al 70 % pasiva el hierro, y si el acero de clase St3 se almacena en ácido sulfúrico al 90 % a una temperatura de 40 °C, entonces, en estas condiciones, la tasa de corrosión no superará las 140 micras por año. Si la temperatura es de 90 °C, la corrosión continuará a un ritmo 10 veces mayor. El ácido sulfúrico con una concentración de hierro del 50 % se disolverá.
El ácido fosfórico (H3PO4) no corroerá el hierro, ni tampoco los solventes orgánicos anhidros como las soluciones alcalinas, el amoníaco acuoso, el Br2 seco y el Cl2.
Si agrega una milésima parte de cromato de sodio al agua, se convertirá en un excelente inhibidor de la corrosión del hierro, como el hexametafosfato de sodio. Pero los iones de cloro (Cl-) eliminan la película protectora de la plancha y aumentan la corrosión.El hierro es técnicamente puro, contiene aproximadamente un 0,16 % de impurezas y es muy resistente a la corrosión.
Aceros de media y baja aleación
Las adiciones de aleación de cromo, níquel o cobre en aceros de baja y media aleación aumentan su resistencia al agua ya la corrosión atmosférica. Cuanto más cromo, mayor es la resistencia a la oxidación del acero. Pero si el cromo es inferior al 12%, entonces los medios químicamente activos tendrán un efecto destructivo en dicho acero.
Aceros de alta aleación
En aceros de alta aleación, los componentes de aleación son más del 10%. Si el acero contiene del 12 al 18% de cromo, dicho acero resistirá el contacto con casi cualquiera de los ácidos orgánicos, con alimentos, será resistente al ácido nítrico (HNO3), bases, muchas soluciones salinas. En un 25% de ácido fórmico (CH2O2), el acero de alta aleación se corroerá a un ritmo de unos 2 mm por año. Sin embargo, los agentes reductores fuertes, el ácido clorhídrico, los cloruros y los halógenos destruirán el acero de alta aleación.
Los aceros inoxidables que contienen de 8 a 11 % de níquel y de 17 a 19 % de cromo son más resistentes a la corrosión que los aceros con alto contenido de cromo solos.Dichos aceros soportan medios oxidantes ácidos, como ácido crómico o ácido nítrico, así como también alcalinos fuertes.
El níquel como aditivo aumentará la resistencia del acero a ambientes no oxidantes, a los factores atmosféricos. Pero el ambiente es ácido, reductor y ácido con iones de halógeno, destruirán la capa de óxido de pasivación, como resultado, el acero perderá su resistencia a los ácidos.
Los aceros inoxidables con la adición de molibdeno en una cantidad de 1 a 4% tienen una mayor resistencia a la corrosión que los aceros al cromo-níquel.El molibdeno dará resistencia al ácido sulfúrico y sulfúrico, ácidos orgánicos, agua de mar y haluros.
El ferrosilicio (hierro con una adición de 13 a 17% de silicio), la llamada fundición de hierro-silicio, tiene resistencia a la corrosión debido a la presencia de una película de óxido de SiO2 y que ni los ácidos sulfúrico, ni nítrico, ni crómico pueden destruir, solo fortalecen esta película protectora. Pero el ácido clorhídrico (HCl) corroerá fácilmente el ferrosilicio.
Aleaciones de níquel y níquel puro

El níquel es resistente a muchos factores, tanto atmosféricos como de laboratorio, al agua limpia y salada, a las sales alcalinas y neutras como carbonatos, acetatos, cloruros, nitratos y sulfatos. Los ácidos orgánicos no oxigenados y no calientes no dañarán el níquel, así como el hidróxido de potasio alcalino (KOH) concentrado en ebullición en una concentración de hasta el 60%.
La corrosión es causada por medios reductores y oxidantes, sales alcalinas o ácidas oxidantes, ácidos oxidantes como el nitrógeno, halógenos gaseosos húmedos, óxidos de nitrógeno y dióxido de azufre.
El metal Monel (hasta un 67 % de níquel y hasta un 38 % de cobre) es más resistente a los ácidos que el níquel puro, pero no resiste la acción de los ácidos oxidantes fuertes. Difiere en una resistencia bastante alta a los ácidos orgánicos, a una cantidad significativa de soluciones salinas. La corrosión atmosférica y del agua no amenaza al metal monel; el fluoruro también es seguro para él. El metal Monel resistirá con seguridad un 40 % de fluoruro de hidrógeno (HF) en ebullición como el platino.
Aleaciones de aluminio y aluminio puro

La película protectora de óxido de aluminio lo hace resistente a los oxidantes comunes, el ácido acético, el flúor, la atmósfera sola y una cantidad significativa de líquidos orgánicos.El aluminio técnicamente puro, en el que las impurezas son inferiores al 0,5%, es muy resistente a la acción del peróxido de hidrógeno (H2O2).
Se destruye por la acción de bases cáusticas en un ambiente fuertemente reductor. El ácido sulfúrico diluido y el oleum no son terribles para el aluminio, pero el ácido sulfúrico de concentración media lo destruirá, al igual que el ácido nítrico caliente.
El ácido clorhídrico puede destruir la película protectora de óxido de aluminio. El contacto del aluminio con el mercurio o las sales de mercurio es destructivo para el primero.
El aluminio puro es más resistente a la corrosión que, por ejemplo, la aleación de duraluminio (que contiene hasta un 5,5 % de cobre, un 0,5 % de magnesio y hasta un 1 % de manganeso), que es menos resistente a la corrosión. Silumin (agregando 11 a 14% de silicio) es más estable en este sentido.
Aleaciones de cobre y cobre puro

El cobre puro y sus aleaciones no se corroen en agua salada o aire. El cobre no teme a la corrosión: bases diluidas, NH3 seco, sales neutras, gases secos y la mayoría de los solventes orgánicos.
Las aleaciones como el bronce, que contienen mucho cobre, resisten la exposición a los ácidos, incluso al ácido sulfúrico diluido en caliente o concentrado en frío, o al ácido clorhídrico concentrado o diluido a temperatura ambiente (25 °C).
En ausencia de oxígeno, el cobre no se corroe en contacto con ácidos orgánicos. Ni el flúor ni el fluoruro de hidrógeno seco tienen un efecto destructivo sobre el cobre.
Pero las aleaciones de cobre y el cobre puro se corroen con varios ácidos si hay oxígeno presente, así como en contacto con NH3 húmedo, algunas sales ácidas, gases húmedos como acetileno, CO2, Cl2, SO2. El cobre interactúa fácilmente con el mercurio, el latón (zinc y cobre) no es muy resistente a la corrosión.
Consulta más detalles aquí — Cobre y aluminio en ingeniería eléctrica.
zinc puro

El agua limpia, como el aire limpio, no corroe el zinc. Pero si hay sales, dióxido de carbono o amoníaco en el agua o el aire, comenzará la corrosión del zinc. El zinc se disuelve en bases, especialmente rápidamente, en ácido nítrico (HNO3), más lentamente, en ácidos clorhídrico y sulfúrico.
Los solventes orgánicos y los productos derivados del petróleo generalmente no tienen efecto corrosivo sobre el zinc, pero si el contacto es prolongado, por ejemplo con gasolina craqueada, la acidez de la gasolina aumentará a medida que se oxida en el aire y comenzará la corrosión del zinc.
Plomo puro

La alta resistencia del plomo al agua ya la corrosión atmosférica es un hecho bien conocido. no se corroe Dirijo y cuando en el suelo. Pero si el agua contiene mucho dióxido de carbono, entonces el plomo se disolverá en ella, ya que se forma bicarbonato de plomo, que ya será soluble.
En general, el plomo es muy resistente a las soluciones neutras, medianamente resistente a las soluciones alcalinas, así como a algunos ácidos: sulfúrico, fosfórico, crómico y sulfúrico. Con ácido sulfúrico concentrado (del 98 %) a una temperatura de 25 °C, el plomo puede disolverse lentamente.
El fluoruro de hidrógeno a una concentración del 48 % disolverá el plomo cuando se caliente. El plomo reacciona fuertemente con los ácidos clorhídrico y nítrico, con el ácido fórmico y acético. El ácido sulfúrico cubrirá el plomo con una capa ligeramente soluble de cloruro de plomo (PbCl2) y no se producirá una mayor disolución. En ácido nítrico concentrado, el plomo también estará recubierto con una capa de sal, pero el ácido nítrico diluido disolverá el plomo. Los cloruros, carbonatos y sulfatos no son agresivos con el plomo, mientras que las soluciones de nitrato son todo lo contrario.
titanio puro

La buena resistencia a la corrosión es un sello distintivo del titanio.No se oxida con oxidantes fuertes, resiste soluciones salinas, FeCl3, etc. Los ácidos minerales concentrados causarán corrosión, pero incluso el ácido nítrico hirviendo en una concentración de menos del 65 %, el ácido sulfúrico (hasta el 5 %, el ácido clorhídrico (hasta el 5 %)) no causarán la corrosión del titanio. La resistencia normal a la corrosión por bases, sales alcalinas y ácidos orgánicos distingue al titanio de otros metales.
Circonio puro

El circonio es más resistente al ácido sulfúrico y clorhídrico que el titanio, pero menos resistente a la aquaregia y al cloro húmedo. Tiene alta resistencia química a la mayoría de las bases y ácidos, resistente al peróxido de hidrógeno (H2O2).
La acción de ciertos cloruros, ácido clorhídrico concentrado en ebullición, agua regia (una mezcla de HNO3 nítrico concentrado (65-68% en peso) y HCl salino (32-35% en peso), ácido sulfúrico concentrado caliente y ácido nítrico fumante- causa En cuanto a la corrosión, esta es una propiedad del circonio como la hidrofobicidad, es decir, este metal no se humedece ni con agua ni con soluciones acuosas.
tantalio puro

La excelente resistencia química del tantalio es similar a la del vidrio. Su densa película de óxido protege el metal a temperaturas de hasta 150 ° C de la acción del cloro, bromo, yodo. La mayoría de los ácidos en condiciones normales no actúan sobre el tantalio, incluso la aquaregia y el ácido nítrico concentrado no causan corrosión. Las soluciones alcalinas prácticamente no tienen efecto sobre el tantalio, pero el fluoruro de hidrógeno actúa sobre él, y se usan soluciones alcalinas calientes concentradas, se usan fundidos alcalinos para disolver el tantalio.
